2. Reaksi E1
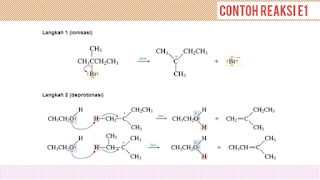
Reaksi eliminasi unimolekuler merupakan sinonim dari reaksi E1, reaksi ini berjalan dalam dua alur . Alur awal terdiri dari ionisasi dan alur selanjutnya yaitu deprotonisasi. Ionisasi ialah putusnya jalinan karbon-halogen yang menghasilkan sesuatu diantara karbokation. Sedangkan deprotonasi adalah tahapan untuk moveon dari proton. untuk lebih jelas perhatikan mekanisme reaksi E1 berikut ini :
Mekanisme reaksi eliminasi E1
Reaksi eliminasi E1 terjadi dalam dua tahap:
1. Tahap lambat
Br dan halida lainnya merupakan leaving group yang baik sehingga Br akan cenderung melepaskan ikatannya dengan C. C yang lebih elektropositif akan kekurangan rapatan elektron sehingga C yang elektropositif akan bermuatan parsial positif dan Br yang lebih elektronegatif bermuatan parsial negatif. setelah Br lepas, maka C akan kekurangan elektron dan menghasilkan sebuah karbokation.
2. Tahap cepat
OR merupakan reaksi nukleofilik yang memiliki pasangan elektron bebas akan menyerah H pada karbon beta. Karbon C beta akan memiliki elektron berlebih, yang kemudian digunakan untuk menstabilkan karbokation dengan membentuk ikatan rangkap antara karbon alfa dan beta.
Contoh reaksi eliminasi E1:
Permasalahan:
1. Mengapa Laju reaksi eliminasi E2 dipengaruhi hanya oleh konsentrasi alkil halida?
2. Mengapa alkil halida tersier bereaksi lebih cepat daripada alkil halida lain?
3. Mengapa setiap reaksi SN1, SN2, E1, E2 selalu berhubungan dengan alkil halida? Mengapa tidak yang lain saja?